例如,我的激光要做21 CFR 1040.10这个条款,必须要有cnas认可,才能出这个报告吗?或者说必须要有a2la、nvlap这类资质实验室出的报告才行吗?
很明确地说: 不管是 CNAS、A2LA 还是 NVLAP,
它们的认可都 👉 不是 FDA 对 21 CFR 1040.10 报告的强制要求。 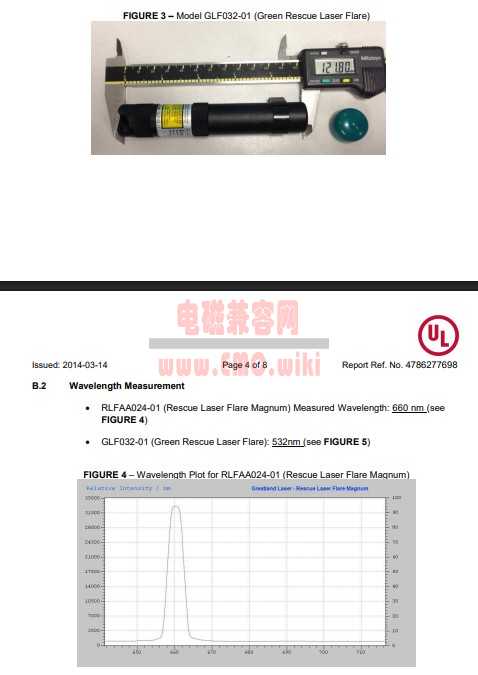
✅ 正确理解:
FDA 对激光产品报告(Laser Product Report)的接受标准,是基于报告内容是否完整、数据是否可信,而不是认证标志。
📌 FDA 官方的立场是:
报告可以由制造商自己撰写;
或由制造商委托第三方代为测量并撰写;
FDA 不指定具体实验室资质;
但报告必须: 使用标准格式(Laser Product Report Form); 对照 21 CFR 1040.10 和 1040.11; 提供足够的技术细节支撑(功率、波长、等级判定、标签说明等); 保证测试数据可追溯、有实际测量基础; 必须由制造商签字并递交给 FDA。
📎 所以:| 实验室认证 | 是否必须? | 说明 | | CNAS | ❌ 不是强制 | 可提升报告可信度,但 FDA 不要求 | | A2LA | ❌ 不是强制 | 是美国常见认可,但非必要 | | NVLAP | ❌ 非强制 | 与 NIST 接轨认可体系,但 FDA 不限定 | | ISO 17025 | ✅ 建议具备 | 若你找第三方出报告,这是最常见认可 | | FDA “批准实验室” | ❌ 没有这回事 | FDA 没有激光实验室白名单 |
🧭 建议你如何操作:✅ 如果自己公司有激光测量能力(波长、功率、激光等级判定),可自行撰写报告并提交 FDA; ✅ 如果委托第三方实验室出报告,可以选具备 ISO 17025 或 CNAS、A2LA 的实验室,不是因为 FDA 强制要求,而是提高买家、客户对报告的认可度;但若对接国外买家,他们可能希望看到带 CNAS 或 ISO 17025 章的报告作为信任依据。 ⚠️ 重点是:报告内容完整,数据真实可追溯,能准确分类并符合 1040.10 要求,这才是 FDA 是否接受的核心。
✅ 扩展阅读:✅ 样板报告下载:
SGS_Class_Test_Report - FDA 21 CFR 1040.10 test report.pdf
https://www.emc.wiki/thread-19094-1-1.html
UL_CDRH_21CFR_Part_1040_Informative_Laser_Report.pdf
https://www.emc.wiki/thread-19094-1-1.html
|